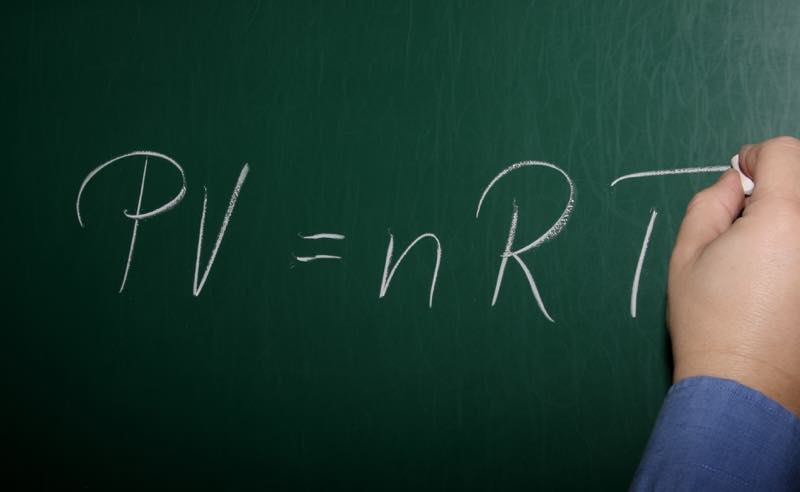In der Thermodynamik ist die ideale Gasgleichung PV=nRT eine fundamentale Zustandsgleichung. Sie beschreibt, wie sich ideale Gase unter verschiedenen Bedingungen verhalten und verknüpft dabei Druck (p), Volumen (V), Temperatur (T) und Stoffmenge (n). Die Gleichung enthält zudem die allgemeine Gaskonstante R. Um die Gasgleichung physik anwenden zu können, werden bestimmte Annahmen getroffen, wie zum Beispiel, dass die Gasmoleküle punktförmig sind, keine Anziehungskräfte aufeinander ausüben und perfekt elastisch zusammenstoßen. In vielen Bereichen der Ingenieurwissenschaften spielt die ideale Gasgleichung eine wichtige Rolle, wenn es darum geht, das Verhalten von Gasen zu berechnen und vorherzusagen.
Was besagt die ideale Gasgleichung?
Die ideale Gasgleichung ist eine fundamentale Beziehung in der Thermodynamik, die den Zusammenhang zwischen Druck, Volumen, Temperatur und Stoffmenge eines idealen Gases beschreibt. Sie ermöglicht es, das Verhalten von Gasen unter verschiedenen Bedingungen vorherzusagen und zu analysieren.
Definition und Formel der idealen Gasgleichung
Die ideale Gasgleichung lautet: pV = nRT. Hierbei steht p für den Druck, V für das Volumen, n für die Stoffmenge in Mol, R für die allgemeine Gaskonstante (8,314 J/mol·K) und T für die absolute Temperatur in Kelvin. Die Gleichung stellt eine Beziehung zwischen diesen Zustandsgrößen her und erlaubt es, eine unbekannte Größe zu berechnen, wenn die anderen gegeben sind.
Annahmen und Voraussetzungen für ideale Gase
Die ideale Gasgleichung basiert auf bestimmten vereinfachenden Annahmen. Ideale Gase bestehen demnach aus punktförmigen Molekülen ohne eigenes Volumen, zwischen denen keine Anziehungskräfte herrschen. Ihre Bewegung ist zufällig und sie stoßen perfekt elastisch. Unter hohen Drücken und niedrigen Temperaturen kann es zu Abweichungen vom Verhalten idealer Gase kommen, da reale Gase dann intermolekulare Kräfte aufweisen. Für viele Anwendungen liefert die ideale Gasgleichung aber eine gute Näherung.
Bedeutung der Variablen p, V, n, R und T
In der idealen Gasgleichung repräsentieren die Variablen folgende physikalische Größen:
- p: Der Druck, dem das Gas ausgesetzt ist.
- V: Das Volumen, das das Gas einnimmt.
- n: Die Stoffmenge des Gases in Mol.
- R: Die allgemeine Gaskonstante, ein universeller Wert von 8,314 J/mol·K.
- T: Die absolute Temperatur des Gases in Kelvin.
Der Druck p und die Temperatur T sind intensive Zustandsgrößen, die unabhängig von der Größe des Systems sind. Das Volumen V und die Stoffmenge n dagegen sind extensive Größen, die sich additiv verhalten. Durch Umstellen der Gleichung lässt sich jede der Variablen berechnen, wenn die anderen bekannt sind.
Anwendung und Herleitung der idealen Gasgleichung
Die ideale Gasgleichung ist ein fundamentales Werkzeug in vielen Bereichen der Naturwissenschaften und Technik. Sie ermöglicht es, das Verhalten von Gasen unter verschiedenen Bedingungen zu beschreiben und vorherzusagen. In diesem Abschnitt werden wir uns genauer mit der Anwendung und Herleitung der Gasgleichung beschäftigen.
Praktische Beispiele zur Anwendung der Gasgleichung
Die Gasgleichung findet in zahlreichen praktischen Anwendungen ihren Einsatz. Hier sind einige Beispiele, die verdeutlichen, wie vielseitig diese Gleichung ist:
- In der Verfahrenstechnik wird die Gasgleichung verwendet, um den Druck in Gasbehältern und Rohrleitungen zu berechnen. Durch Kenntnis von Temperatur, Volumen und Stoffmenge lässt sich der Druck präzise bestimmen.
- Bei der Auslegung von Pneumatiksystemen und Klimaanlagen kommt die Gasgleichung ebenfalls zum Einsatz. Sie hilft dabei, die erforderlichen Komponenten wie Kompressoren und Ventile korrekt zu dimensionieren.
- Meteorologen nutzen die Gasgleichung, um atmosphärische Phänomene wie Luftdruck und Temperaturänderungen zu beschreiben. Dadurch lassen sich Wettervorhersagen erstellen und Klimamodelle entwickeln.
Herleitung der idealen Gasgleichung aus den Gasgesetzen
Die ideale Gasgleichung ist keine eigenständige Formel, sondern ergibt sich aus der Kombination mehrerer grundlegender Gasgesetze. Jedes dieser Gesetze beschreibt einen spezifischen Zusammenhang zwischen den Zustandsgrößen eines Gases:
- Das Boyle-Mariotte-Gesetz besagt, dass bei konstanter Temperatur das Produkt aus Druck und Volumen konstant bleibt (pV=const).
- Die Gesetze von Gay-Lussac stellen fest, dass sowohl der Druck als auch das Volumen eines Gases proportional zur Temperatur sind (p~T bzw. V~T).
- Nach dem Avogadro-Gesetz ist das Volumen eines Gases proportional zur Stoffmenge (V~n).
Durch geschickte Kombination dieser Gesetze erhält man schließlich die allgemeingültige Formel pV=nRT, die als ideale Gasgleichung bekannt ist. Sie vereint alle Zustandsgrößen eines idealen Gases in einer einzigen Gleichung.
Zusammenhang mit dem Gesetz von Amontons
Das Gesetz von Amontons ist ein weiteres wichtiges Gasgesetz, das eng mit der idealen Gasgleichung verknüpft ist. Es beschreibt den Zusammenhang zwischen Dichte, Druck und Temperatur eines idealen Gases. Konkret besagt es, dass die Dichte proportional zum Druck und umgekehrt proportional zur Temperatur ist.
Dieses Gesetz lässt sich direkt aus der idealen Gasgleichung herleiten, indem man diese nach der Dichte auflöst. Beim Expandieren oder Komprimieren eines Gases ändert sich somit die Dichte in Abhängigkeit von Druck und Temperatur – genau wie es die Gasgleichung vorhersagt. Amontons Gesetz veranschaulicht auf elegante Weise, wie die ideale Gasgleichung das Verhalten von Gasen erklärt und mit anderen Gasgesetzen zusammenhängt.
Fazit
Die ideale Gasgleichung pV=nRT ist ein leistungsfähiges Instrument, um Gase zu verstehen und ihr Verhalten vorherzusagen. Sie verknüpft die zentralen Zustandsgrößen Druck, Volumen, Temperatur und Stoffmenge durch eine kompakte mathematische Formel. Obwohl die Gleichung von einem vereinfachten Modell ausgeht, liefert sie in vielen praktischen Fällen erstaunlich genaue Ergebnisse.
Mit Hilfe der idealen Gasgleichung kannst du das Gasverhalten berechnen und wichtige Fragen beantworten: Wie ändert sich der Druck, wenn das Volumen verkleinert wird? Welchen Einfluss hat die Temperatur auf die Teilchenbewegung? Die Formel ermöglicht es, die Zusammenhänge zwischen den Gasvariablen quantitativ zu erfassen und präzise Vorhersagen zu treffen.
Die Herleitung der Gasgleichung lässt sich auf fundamentale Gesetzmäßigkeiten wie die Gasgesetze von Boyle-Mariotte, Gay-Lussac und Avogadro zurückführen. Dadurch ist sie tief in den Grundlagen der Thermodynamik verankert. Als universelles Werkzeug ist die ideale Gasgleichung unverzichtbar für Naturwissenschaftler, Ingenieure und alle, die die faszinierende Welt der Gase besser verstehen und mit ihnen arbeiten möchten.